KITA HEBAT – Halo sahabat, kali ini kita akan membahas soal jelaskan pengertian reaksi redoks !
Mungkin saja sahabat akan menemukan soal jelaskan pengertian reaksi redoks pada pelajaran kimia tingkat SMA.
Jadi reaksi redoks adalah salah satu konsep fundamental dalam kimia yang melibatkan perubahan bilangan oksidasi dari atom unsur sebelum dan sesudah reaksi terjadi.
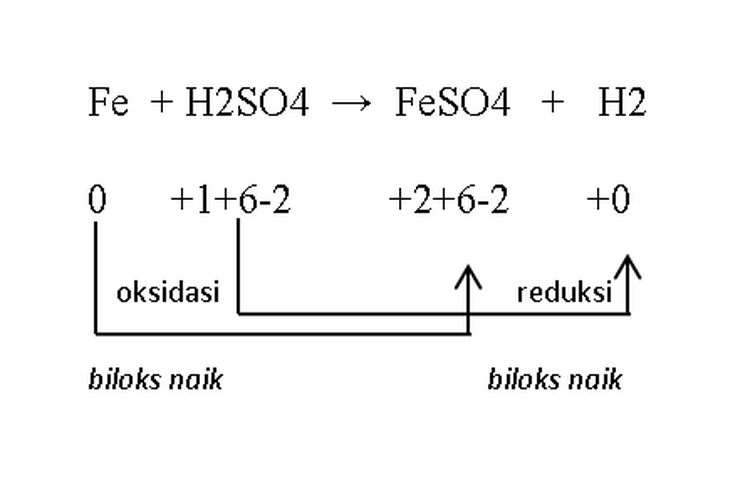
Pada dasarnya, reaksi redoks terdiri dari dua jenis reaksi yaitu reaksi oksidasi dan reaksi reduksi. Reaksi oksidasi adalah proses di mana bilangan oksidasi suatu unsur meningkat, sedangkan reaksi reduksi adalah proses di mana bilangan oksidasi suatu unsur menurun.
Artikel ini akan menjelaskan secara mendalam tentang jelaskan pengertian reaksi redoks, konsep dasar yang melandasinya, serta contoh-contoh reaksinya.
Pengertian Dasar Reaksi Redoks
Oksidasi dan Reduksi Berdasarkan Pengikatan dan Pelepasan Oksigen
Dalam konsep awal, oksidasi diartikan sebagai proses pengikatan oksigen oleh suatu unsur atau senyawa, sedangkan reduksi adalah proses pelepasan oksigen dari suatu senyawa.
Contoh klasik dari reaksi oksidasi adalah pembakaran magnesium dalam oksigen yang menghasilkan magnesium oksida:
2Mg (s) + O_2 (g) → 2MgO (s)
Pada reaksi ini, magnesium (Mg) mengalami oksidasi dengan mengikat oksigen (O_2), membentuk magnesium oksida (MgO). Sebaliknya, pada reaksi reduksi, oksigen dilepaskan dari senyawanya. Contoh reaksi reduksi adalah dekomposisi tembaga(II) oksida:
2CuO → 2Cu + O_2
Pada reaksi ini, tembaga(II) oksida (CuO) mengalami reduksi dengan melepaskan oksigen (O_2), menghasilkan tembaga (Cu) dan oksigen bebas.
Oksidasi dan Reduksi Berdasarkan Pengikatan dan Pelepasan Elektron
Konsep lebih lanjut mengartikan oksidasi sebagai pelepasan elektron dari suatu unsur atau senyawa, sedangkan reduksi adalah penerimaan elektron oleh suatu unsur atau senyawa.
Dalam konteks ini, unsur atau senyawa yang melepaskan elektron disebut reduktor, dan yang menerima elektron disebut oksidator.
Contoh reaksi antara magnesium dan oksigen membentuk magnesium oksida dapat dijelaskan sebagai berikut:
Oksidasi:
Mg → Mg^{2+} + 2e^-
Reduksi:
frac{1}{2}O_2 + 2e^- → O^{2-}
Gabungan reaksi ini menghasilkan:
Mg + frac{1}{2}O_2 → MgO
Pada reaksi ini, magnesium (Mg) mengalami oksidasi menjadi ion magnesium (Mg²⁺), sehingga Mg adalah reduktor. Sementara itu, oksigen (O_2) mengalami reduksi menjadi ion oksigen (O²⁻), sehingga O_2 adalah oksidator.

Konsep Bilangan Oksidasi
Pengertian Bilangan Oksidasi
Bilangan oksidasi (biloks) adalah angka yang menggambarkan jumlah elektron yang hilang atau diperoleh oleh suatu atom dalam senyawa.
Beberapa aturan dasar untuk menentukan bilangan oksidasi antara lain:
- Bilangan oksidasi atom dalam unsur bebas adalah 0.
- Bilangan oksidasi ion monoatomik sama dengan muatan ionnya.
- Jumlah bilangan oksidasi dalam senyawa netral adalah 0, sedangkan dalam ion poliatomik sama dengan muatan ionnya.
- Bilangan oksidasi unsur-unsur golongan VII A dalam senyawa biner adalah -1.
- Bilangan oksidasi hidrogen dalam senyawa dengan non-logam adalah +1, dan dalam senyawa dengan logam atau boron adalah -1.
- Bilangan oksidasi oksigen dalam senyawa adalah -2, kecuali dalam senyawa dengan fluor, peroksida, dan superoksida.
- Bilangan oksidasi logam golongan IA dalam senyawa adalah +1.
- Bilangan oksidasi logam golongan IIA dalam senyawa adalah +2.
Contoh Penghitungan Bilangan Oksidasi
Berikut ini beberapa contoh perhitungan bilangan oksidasi:
a. NH₄VO₂
NH₄VO₂ → NH₄^+ + VO₂^-
Pada ion VO₂⁻:
Biloks V} + 2(Biloks O}) = -1
Biloks V} + 2(-2) = -1
Biloks V} = +4 – 1 = +3
b. K₄V(CN)₆
K₄V(CN)₆ → K₄^+ + V(CN)₆^6⁻
Pada ion V(CN)₆^6⁻:
4(Biloks K) + Biloks V = +6
4(+1) + Biloks V} = +6
Biloks V} = +6 – 4 = +2
c. VSO₄
VSO₄ → V^{a+} + SO₄^{2-}
Pada ion V:
Biloks V + Biloks SO₄}^2- = 0
Biloks V + (-2) = 0
Biloks V = +2
d. VOSO₄
VOSO₄ → (VO)^{2+} + SO₄^{2-}
Pada ion (VO)²⁺:
Biloks V + Biloks O = +2
Biloks V + (-2) = +2
Biloks V = +2 + 2 = +4
e. VCl₃
Biloks V + 3(Biloks Cl) = 0
Biloks V + 3(-1) = 0
Biloks V = +3
Kesimpulan
Reaksi redoks adalah reaksi kimia yang melibatkan perubahan bilangan oksidasi atom unsur sebelum dan sesudah reaksi.
Reaksi ini meliputi oksidasi, yang merupakan peningkatan bilangan oksidasi, dan reduksi, yang merupakan penurunan bilangan oksidasi.
Dengan memahami konsep-konsep dasar ini, kita dapat lebih mudah memahami berbagai reaksi kimia yang terjadi di sekitar kita, baik dalam kehidupan sehari-hari maupun dalam industri.
Bilangan oksidasi adalah alat penting dalam menentukan jenis reaksi yang terjadi dan peran zat dalam reaksi tersebut, apakah sebagai oksidator atau reduktor.
Itulah pengertian reaksi redoks, semoga dapat menambah wawasan sahabat semua.